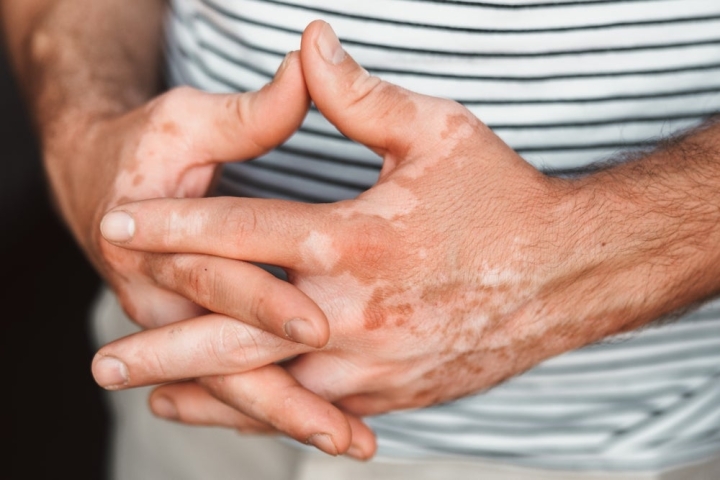
Компания AbbVie может получить восьмое показание для своего ведущего ингибитора янус-киназы (JAK) Rinvoq (упадацитиниб) после успешного завершения двух крупномасштабных исследований по лечению несегментарного витилиго (НСВ).
В рамках исследований Viti-Up (NCT06118411) препарат достиг своей первичной конечной точки. У 19,4% и 21,5% пациентов в первом и втором исследованиях соответственно было зафиксировано 50%-ное снижение индекса площади поражения витилиго (T-VASI 50) по сравнению с исходным уровнем.
Терапия Rinvoq также продемонстрировала улучшение показателей индекса площади поражения витилиго на лице (F-VASI 75). К 48-й неделе 75%-ное очищение лицевой области от витилиго было достигнуто у 25,2% и 23,4% пациентов.
Кроме того, Rinvoq достиг своей вторичной конечной точки, показав 50%-ное очищение лица от витилиго у 48,1% и 43,4% пациентов, получавших препарат, в обоих исследованиях.
Профиль безопасности Rinvoq при НСВ оказался сопоставимым с таковым для других одобренных показаний. Наиболее частыми нежелательными явлениями, связанными с лечением (TEAEs), были назофарингит, инфекции верхних дыхательных путей и акне.
Серьезные нежелательные явления (SAEs) наблюдались у 3,9% и 4% пациентов в группе Rinvoq, однако ни одно из них не относилось к крупным сердечно-сосудистым или венозным тромбоэмболическим событиям.
Тьерри Пассерон, профессор и заведующий кафедрой дерматологии Университета Лазурного берега, отметил, что эти результаты свидетельствуют: «воздействие на основное воспаление», связанное с НСВ, может предоставить пациентам вариант лечения, который «помогает добиться видимых результатов».
Многообещающие результаты исследований Viti-Up следуют за двойным успехом Rinvoq в III фазе испытаний при гнездной алопеции. Эти данные уже побудили AbbVie подать заявку на одобрение препарата в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA).
Оба эти достижения станут значительной победой для AbbVie, которая в настоящее время полагается на свой иммунологический портфель – в особенности на Skyrizi (ризанкизумаб) и Rinvoq – чтобы компенсировать снижение продаж своего бестселлера Humira, патент на который недавно истек.
Для продления рыночной ценности Rinvoq компания AbbVie недавно увеличила эксклюзивность препарата на рынке на четыре года – до 2037 года. Американская фармацевтическая компания достигла этого, заключив соглашения с производителями дженериков, которые планировали коммерциализировать копии препарата к дате истечения патента в 2033 году.
В случае получения одобрения при витилиго, Rinvoq станет одним из двух таргетных препаратов, доступных на рынке. Топический ингибитор JAK Opzelura (ругсолитиниб) от Incyte Corporation уже получил разрешение FDA в 2022 году.
Аналитики GlobalData прогнозируют, что Opzelura займет лидирующую позицию на рынке по сравнению с Rinvoq, если последний получит одобрение по этому показанию. Согласно прогнозам, в 2031 году объем продаж препарата AbbVie при НСВ достигнет 562 млн долларов США по всему миру.
Тем временем аналитики GlobalData оценивают, что мировые продажи Opzelura только по показанию НСВ к 2031 году составят 590 млн долларов США. Это, вероятно, объясняется местным способом применения Opzelura, что обеспечивает большее удобство для пациентов.
Однако Rinvoq — не единственный пероральный ингибитор JAK, претендующий на долю рынка НСВ. Препарат Litfulo (ритлецитиниб) компании Pfizer в настоящее время исследуется в III фазе исследования Tranquillo (NCT05583526). Ожидается, что это исследование будет завершено в марте 2026 года, согласно данным ClinicalTrials.gov.
Помимо НСВ, ожидается, что продажи Rinvoq достигнут статуса мегаблокбастера к 2027 году, а пик продаж препарата придется на 2031 год, составив 15 млрд долларов США.


